Tác giả: Phó Giáo sư. Dược sĩ nguyễn đình luyên.
Bài báo được kết tinh là gì? Cấu tạo và nguyên lý làm việc của thiết bị kết tinh được trích từ chương 5 của “Một số Quá trình và Thiết bị trong Công nghệ Dược – Trường Cao đẳng Dược Hà Nội, Trường Đại học Công nghệ Dược, Giáo trình Bồi dưỡng Dược sĩ”.
Mục tiêu học tập
- Cơ sở lý thuyết của các phương pháp kết tinh từ trạng thái nóng chảy, dung dịch và thăng hoa được trình bày.
- Giới thiệu cấu tạo và nguyên lý hoạt động của tinh thể. Thiết bị kết tinh.
Kết tinh là quá trình tách chất rắn tinh khiết khỏi các trạng thái ban đầu khác nhau của chúng, chẳng hạn như hơi (thăng hoa), chất lỏng (ngưng tụ) và hỗn hợp từ các dung dịch quá bão hòa (kết tinh phân đoạn). Trong số đó, phương pháp kết tinh dung dịch là phương pháp quan trọng nhất. Đây là phương pháp chính để thu được chất rắn tinh khiết và được sử dụng rộng rãi trong quá trình tinh chế các hợp chất dược phẩm.
1. Kết tinh từ trạng thái nóng chảy
Kết tinh từ trạng thái nóng chảy là quá trình kết tinh tách hỗn hợp các chất có tốc độ dòng chảy khác nhau khi làm lạnh một cách có kiểm soát. Quá trình này có ưu điểm hơn so với chưng cất vì nó cần ít năng lượng hơn để tách các chất. Mặt khác, do quá trình được thực hiện ở nhiệt độ thấp hơn nên nó ít ảnh hưởng đến các chất không bền nhiệt và dễ ứng dụng trong công nghiệp. Tuy nhiên, sản phẩm thu được chỉ là tương đối tinh khiết.
1.1. Nguyên tắc cơ bản của phương pháp
Không phải tất cả các chất đều được tách ra khỏi hỗn hợp nóng chảy bằng cách kết tinh. Sự lựa chọn của quá trình kết tinh phụ thuộc vào sự cân bằng pha, điều này sẽ quyết định tính khả thi của quá trình. Chúng ta thường gặp những tình huống cơ bản sau.
1.1.1. Một trường hợp hình thành đồng tinh thể đơn giản trong hệ nhị phân
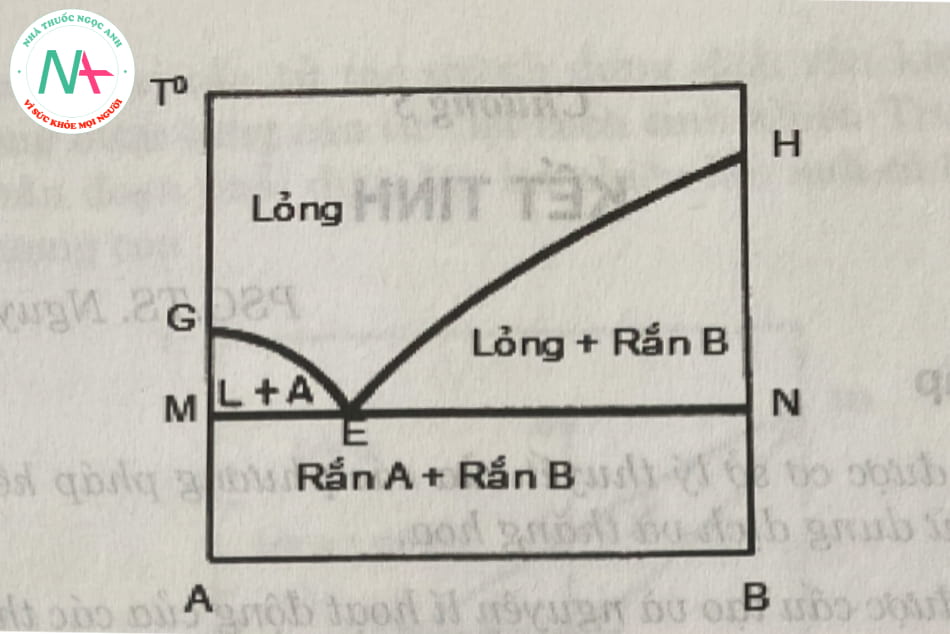
Đây là trường hợp đơn giản nhất và chỉ cần 1 bước làm lạnh để kết tinh các thành phần tinh khiết từ hỗn hợp nóng chảy, giản đồ pha được thể hiện trong hình 5.1. Ở trạng thái lỏng, các thành phần hòa tan hoàn toàn vào nhau, còn ở trạng thái rắn, các thành phần được kết tinh riêng biệt (không tạo thành dung dịch rắn).
Khu vực phía trên đường geh là chất lỏng. Vùng đá quý là vùng cân bằng giữa hai pha rắn a, và pha lỏng là dung dịch bão hòa của chất rắn kết tinh a. Vùng hen là vùng cân bằng giữa hai pha rắn b và lỏng bão hoà b.
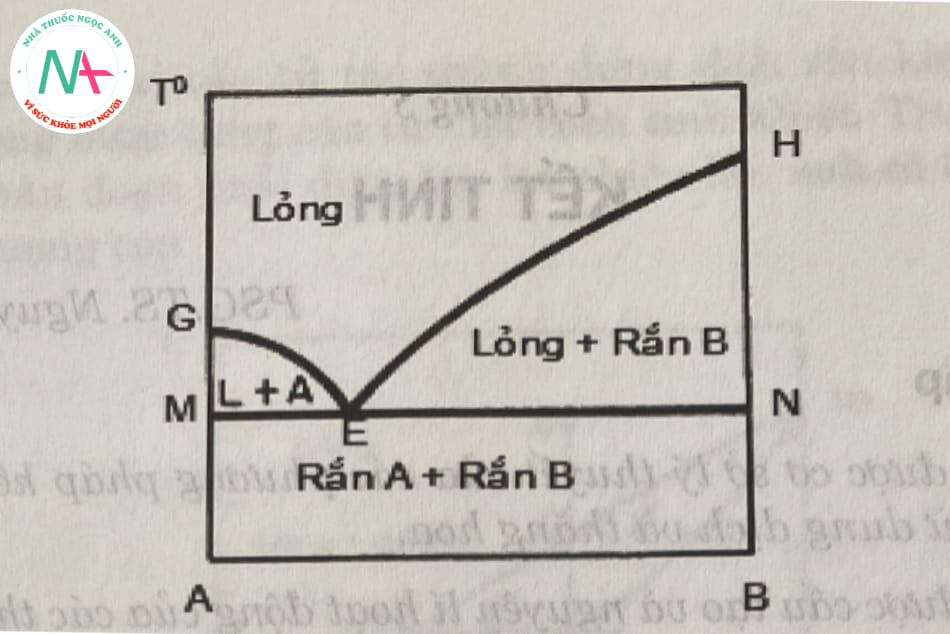
Vùng nằm dưới đường MN tồn tại hai pha rắn là A và B. Đường GE là đường kết tinh rắn A, đường kết tinh rắn B là HE. Điểm E gọi là điểm eutectic biểu diễn dung dịch lỏng bão hoà cả rắn A và rắn B.
Quá trình làm lạnh dung dịch lỏng đến một thời điểm nào đó trên he, dung dịch bắt đầu đạt trạng thái bão hòa rắn b. Từ đó làm lạnh tiếp hệ sẽ có hai pha cân bằng với nhau là chất rắn kết tinh b và dung dịch rắn bão hòa b. Ở trạng thái này có thể thu được tinh thể rắn b nguyên chất. Tuy nhiên, khái niệm về độ tinh khiết trong trường hợp này chỉ là tương đối, vì sản phẩm có nhiều tạp chất là chất lỏng bám trên bề mặt tinh thể và không thể rửa trôi.
1.1.2. Trường hợp hệ thống hai thành phần tạo thành dung dịch rắn không hạn chế
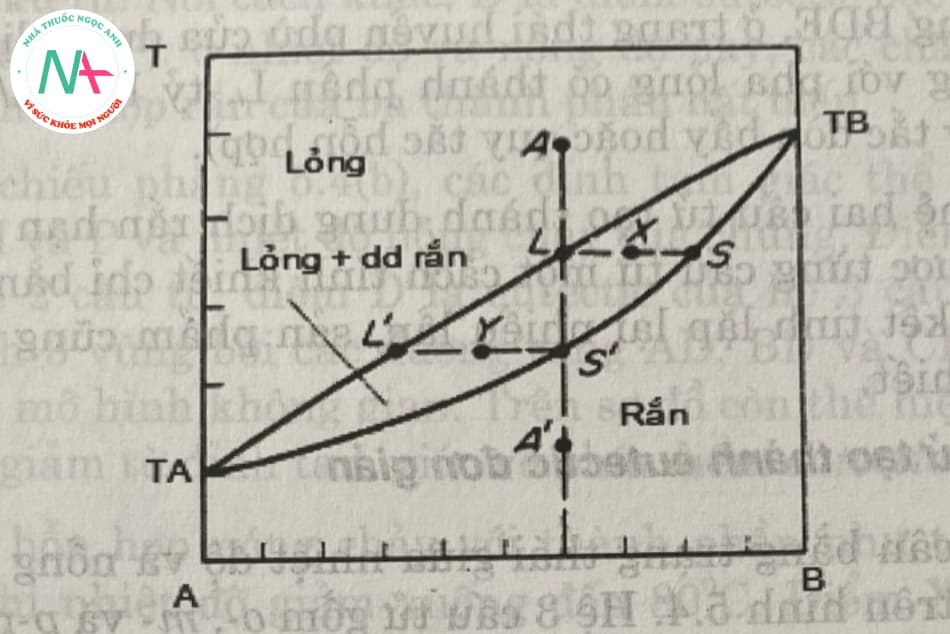
Biểu đồ pha được thể hiện trong Hình 5.2. Trục tung thể hiện nhiệt độ và trục hoành thể hiện thành phần hỗn hợp. Điểm ta và tb là nhiệt độ nóng chảy của các thành phần nguyên chất a và b. Hình 5.2 cũng cho thấy rằng việc tăng nồng độ của một thành phần đều đặn sẽ làm tăng (hoặc giảm) nhiệt độ bắt đầu kết tinh của hệ thống. Đường cong tal’ltb là đường cong cân bằng pha lỏng, đường cong tas’stb là đường cong cân bằng pha rắn và trạng thái trung gian là dung dịch lỏng + rắn.
Điểm x biểu diễn trạng thái cân bằng của pha lỏng của thành phần l với pha rắn của thành phần s, và điểm y tương ứng cũng là điểm cân bằng của pha lỏng của thành phần l ‘với pha rắn của thành phần s’. Khi hệ bắt đầu kết tinh, làm nguội hỗn hợp a từ vùng hoàn toàn lỏng thành l. Tinh thể pha rắn đầu tiên tại s giàu b hơn so với dung dịch lỏng ban đầu a. Hệ thống có hai giai đoạn: dung dịch lỏng và dung dịch rắn. Khi tiếp tục làm lạnh, nhiều tinh thể sẽ được tách ra, nhưng hàm lượng của chúng thay đổi dọc theo đường cong ss. Tương ứng, thành phần của ngoại hình cũng thay đổi dọc theo đường cong.
Trong trường hợp hệ thống hai thành phần tạo thành dung dịch rắn không bị hạn chế, rất khó để tách các thành phần một cách thuần túy. Tình huống này đòi hỏi phải lặp lại nhiều lần bước chưng cất phân đoạn để thu được lượng sản phẩm cao.
1.1.3. Trường hợp hệ hai cấu tử có tạo thành dung dịch rắn hạn chế
Điều này thường xảy ra với các hợp chất hữu cơ. Giản đồ pha đơn giản trong trường hợp này tương tự như giản đồ của một hệ thống hai thành phần eutectic đơn giản (Hình 5.1). Tuy nhiên, đường kết tinh ae không phải là kết tinh nguyên chất a mà là dung dịch rắn b (gọi là dung dịch rắn a) trong đó các tinh thể hòa tan thành a, và hàm lượng b tăng khi nhiệt độ kết tinh giảm. Theo cách tương tự, đường được kết tinh ra khỏi dung dịch rắn a (gọi là dung dịch rắn β) tan trong dung dịch b.
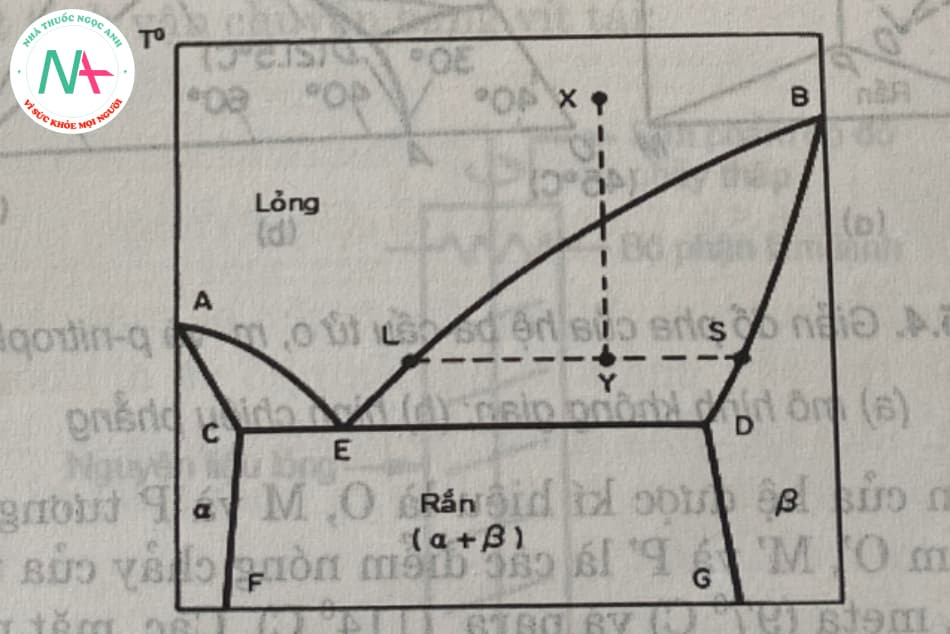
Phía trên đường AEB là vùng lỏng đồng nhất, phía dưới đường ACEDB là vùng rắn. Vùng các hình quạt bên trái ACF và bên phải BDG là pha rắn ở trạng thái dung dịch rắn đồng nhất. Vùng giới hạn bởi đường FCEDG là hỗn hợp không đồng nhất của 2 dung dịch rắn (α+β). Vùng nằm trong giới hạn của các đường ACE và BDE chứa hỗn hợp lỏng + dung dịch rắn α và lỏng + dung dịch rắn β. Điểm E có nhiệt độ và thành phần của điểm eutectic, nó là một khối dung dịch rắn.
Khi làm lạnh hỗn hợp lỏng x thành y, ta có thể quan sát thấy những điều sau: Điểm y nằm trong vùng bde, trong một huyền phù, trong đó dung dịch rắn có thành phần s cân bằng với pha lỏng có thành phần l, tỷ lệ rắn / lỏng bằng yl / ys (Đòn bẩy hoặc Kết hợp).
Trong trường hợp hệ thống hai thành phần tạo thành dung dịch rắn có giới hạn, cũng không thể tách từng thành phần thành dạng tinh khiết chỉ bằng một bước làm lạnh. Quá trình kết tinh được lặp lại nhiều lần và sản phẩm không hoàn toàn tinh khiết.
1.1.4. Hệ thống ba thành phần tạo thành các đồng tinh thể đơn giản
Mối quan hệ cân bằng trạng thái giữa nhiệt độ và nồng độ của hệ ba thành phần được thể hiện trong Hình 5.4. Trong trường hợp này, hệ thống ba thành phần gồm ortho-, meta- và p-nitrophenol được chọn để minh họa.
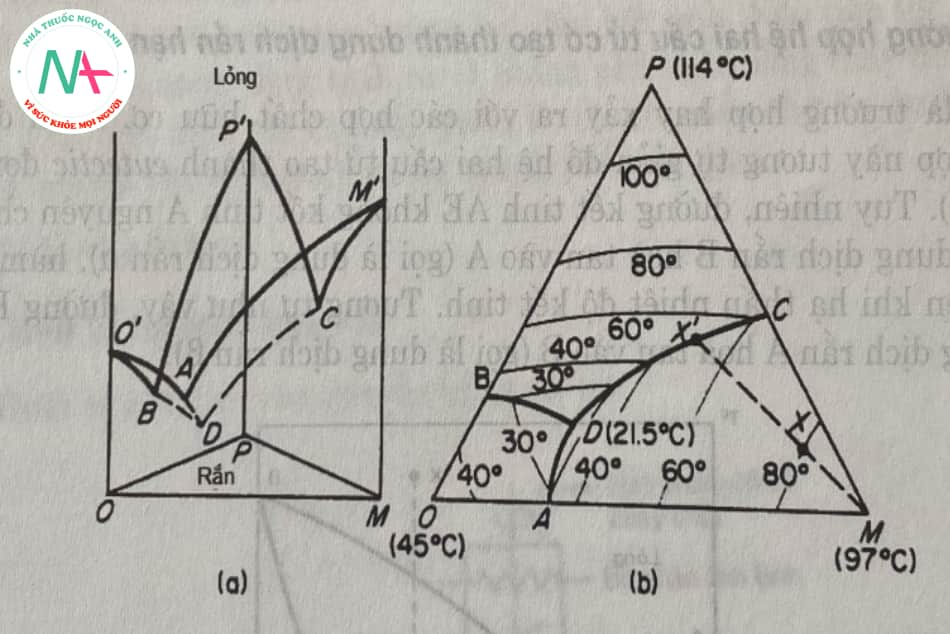
Ba thành phần của hệ được kí hiệu là O, M và P tương ứng. Trên hình 5.4 (a) ta thấy điểm O’, M’ và P’ là các điểm nóng chảy của thành phần tinh khiết ortho (45°C), meta (97° C) và para (114° C). Các mặt phẳng đứng là sơ đồ thể hiện giản đồ pha của ba hệ thống hai cấu tử O-M, O-P và M-P.
Đồng tinh thể của hệ 2 thành phần được biểu diễn tại các điểm a (31,5 ° c; 72 5% o, 27,5% m), b (33,5 ° c; 75,5% o, 24) .5% m ) và c (61,5 ° c; 54,8% m, 45 2% p). Các đường cong quảng cáo cho thấy ảnh hưởng của việc thêm thành phần p vào hệ thống 0-m. Tương tự như vậy, các đường cong bd và cd đại diện cho điểm lõm của hệ thống hai thành phần với các đồng tinh thể b và c sau khi thêm thành phần thứ ba.
Điểm d là điểm có nhiệt độ thấp nhất, nơi tồn tại trạng thái cân bằng rắn – lỏng của hệ ba thành phần. Nói cách khác, d là điểm eutectic bậc 3 (21,5 ° c; 57,7% o 23,2% m, 19,1% p). Ở nhiệt độ và nồng độ này, chất lỏng đóng băng để tạo thành một hỗn hợp rắn gồm ba thành phần bất biến.
Trên hình chiếu phẳng 5.4 (b), các đỉnh hình tam giác biểu diễn các thành phần nguyên chất o, m, và p và nhiệt độ nóng chảy của chúng. Các điểm a, b và c là đồng tinh thể của hệ 2 thành phần và điểm d là đồng tinh thể của hệ 3 thành phần. Biểu đồ pha được chia thành 3 vùng bởi các đường cong ad, bd và cd đại diện cho ba bề mặt pha lỏng trong mô hình không gian. Hình vẽ cũng cho thấy đường đẳng nhiệt, với nhiệt độ giảm dần từ đỉnh của tam giác về phía điểm eutectic d.
Chúng tôi coi thành phần của hỗn hợp nóng chảy là điểm x, bắt đầu kết tinh khi nhiệt độ giảm xuống 80 ° C. Điểm x nằm trong vùng adcm, do đó, khi nhiệt độ giảm hơn nữa, đồng phân meta tinh khiết được tách ra. Các thành phần còn lại thay đổi độ hòa tan của chúng dọc theo đường mxx ‘. Tại x ‘, thành phần thứ hai (para-) cũng bắt đầu kết tinh. Nếu tiếp tục làm lạnh, các vị trí meta và para bị tách ra và thành phần pha lỏng thay đổi theo hướng x’d. Khi nhiệt độ đạt đến điểm d, thành phần thứ ba (ortho) kết tinh và hệ pha rắn tách khỏi thành phần ổn định.
1.2. Thiết bị kết tinh
1.2.1. Bộ kết tinh dạng cột
– Máy kết tinh truyền tải trục vít:
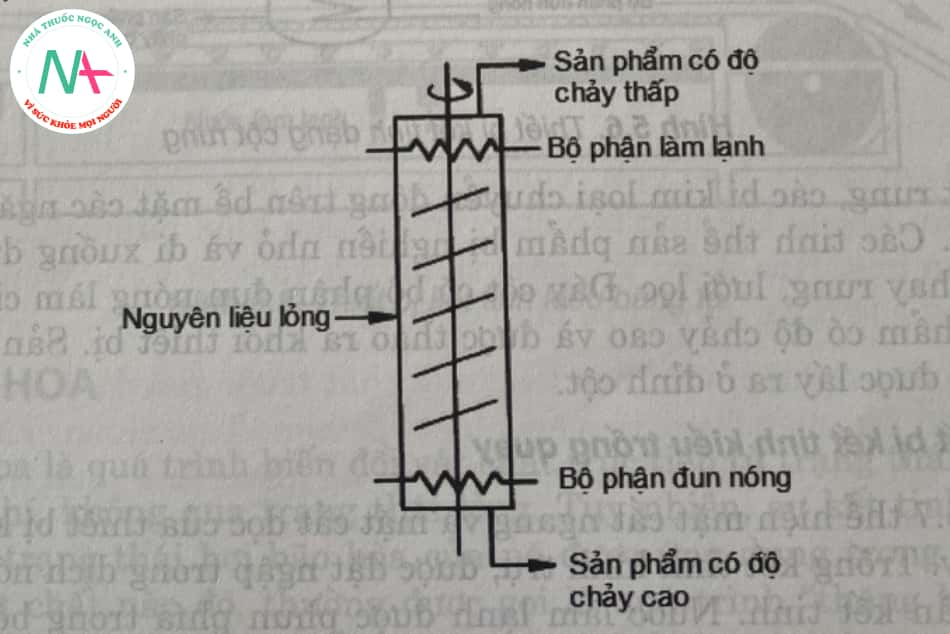
Hình 5.5 là sơ đồ nguyên lí cột kết tinh vận chuyển bằng vít tải (cột Schildknecht). Nguyên lí hoạt động của thiết bị này như sau:
Nguyên liệu lỏng được đưa vào giữa tháp và các tinh thể của sản phẩm dòng cao kết tinh trước nhờ thiết bị làm mát ở đỉnh tháp. Các tinh thể này di chuyển ngược dòng đến dạng nóng chảy, do đó các bề mặt tinh thể được rửa sạch. Ở đáy tháp, nó bị bộ phận đốt nóng làm nóng chảy và đẩy ra ngoài. Một phần của sản phẩm có nhiệt độ nóng chảy thấp được rút ra dưới dạng chất lỏng ở trên cùng của cột.
– Bộ kết tinh cột rung:
Hình 5.6 mô tả sơ đồ của thiết bị khuôn cột rung. Nguyên liệu thô được đưa qua máy làm lạnh để tạo thành bùn kết tinh. Sau đó, nhập một cột kết tinh gồm nhiều ngăn chứa đầy các quả cầu kim loại.
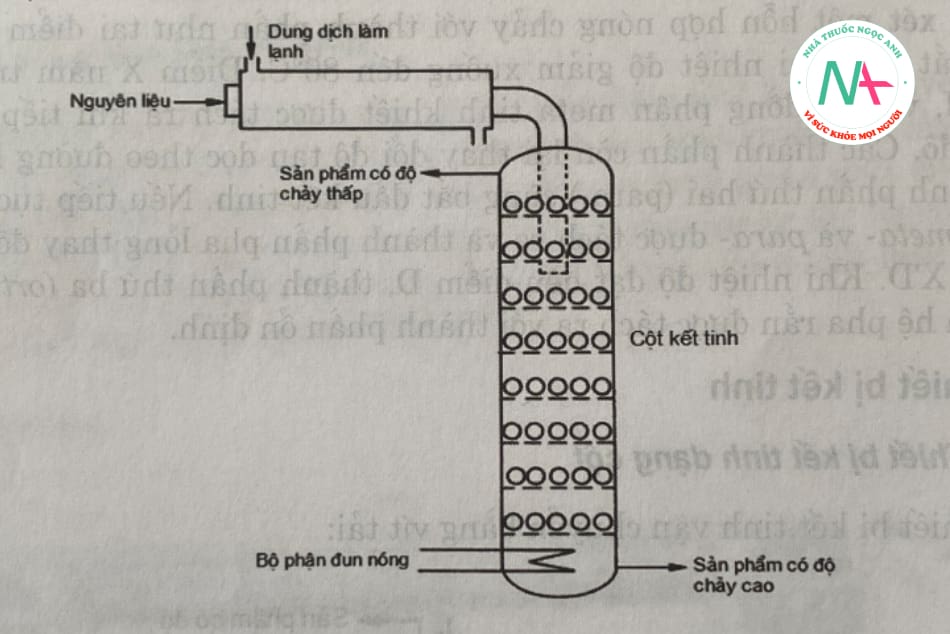
Do cột rung, các bi kim loại chuyển động trên bề mặt các ngăn giống như mặt sàng. Các tinh thể sản phẩm bị nghiền nhỏ và đi xuống dưới qua một loạt các khay rung, lưới lọc. Đáy cột có bộ phận đun nóng làm chảy các tinh thể sản phẩm có độ chảy cao và được tháo ra khỏi thiết bị. Sản phẩm có độ chảy thấp được lấy ra ở đỉnh cột.
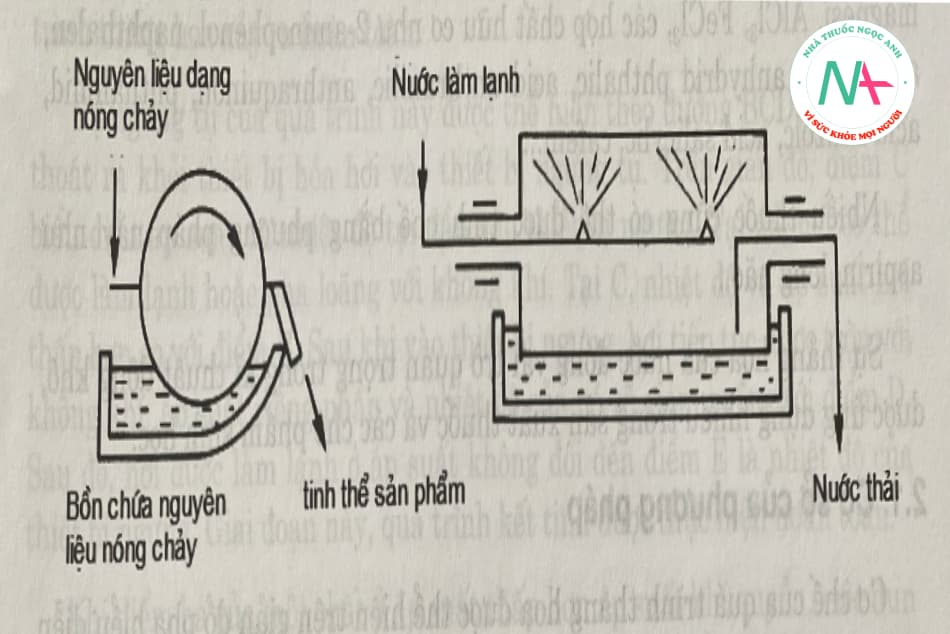
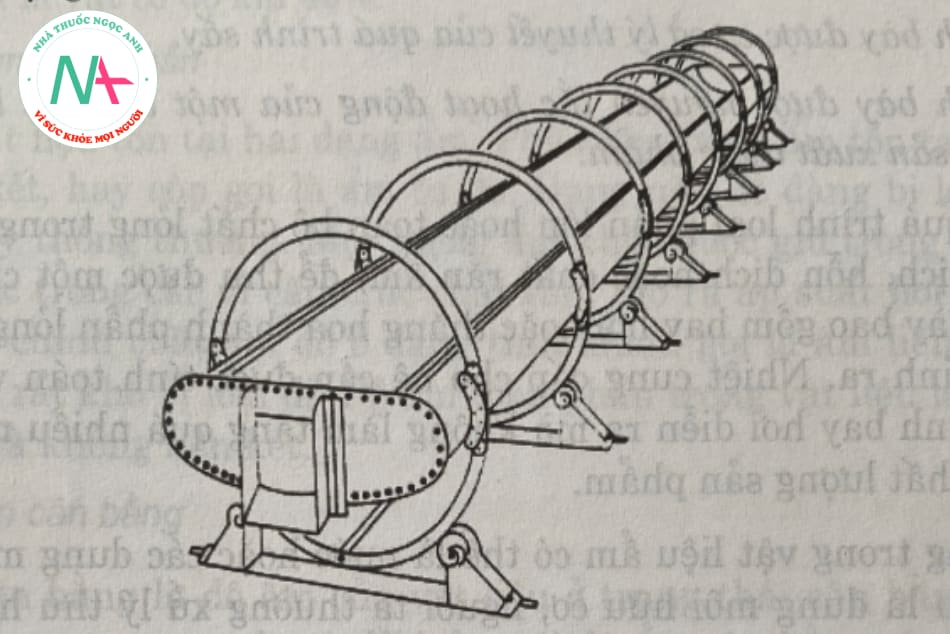
1.2.2. Máy kết tinh trống quay
Hình 5.7 cho thấy mặt cắt ngang và mặt cắt dọc của khuôn trống. Trống kết tinh hình trụ, được nhúng vào chất lỏng nóng chảy để kết tinh. Chất làm mát được phun trên bề mặt của trống. Sản phẩm kết tinh tạo thành một lớp kết tinh mỏng trên bề mặt trống lạnh, lớp này được lấy ra bằng lưỡi gạt kết tinh. Nhiệt độ nước làm mát được điều chỉnh để kết tinh các sản phẩm nóng chảy cao trong quá trình vận hành của thiết bị, và các sản phẩm có lưu lượng thấp được làm giàu trong bể nấu chảy và thải ra ngoài riêng biệt.
1.2.3. Thiết bị kết tinh kiểu băng tải
Thiết bị bao gồm một hệ thống băng tải được di chuyển bằng 2 trục truyền động. Xịt nước lạnh vào đáy thắt lưng dọc theo chiều dài của thắt lưng. Vật liệu lỏng được đưa vào một phía và phân bố đều trên bề mặt băng tải. Các tinh thể sản phẩm được loại bỏ ở mặt sau. Thời gian kết tinh cho từng chất khác nhau có thể được điều chỉnh bằng cách điều chỉnh tốc độ của băng tải (Hình 5.8).
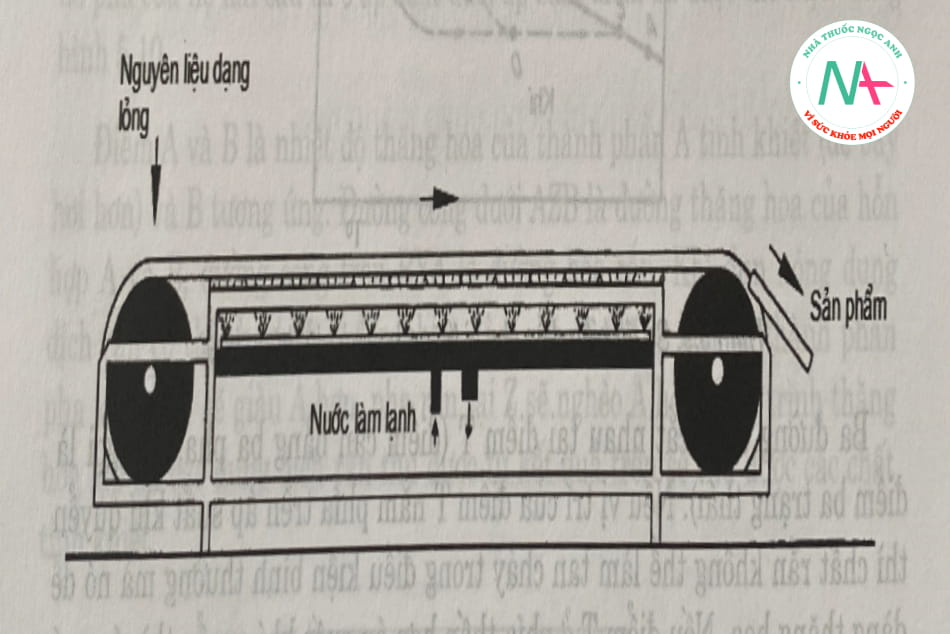
2. Thăng hoa
Sự thăng hoa là quá trình biến đổi một chất trực tiếp từ trạng thái rắn sang trạng thái khí mà không qua trạng thái lỏng. Tuy nhiên, chất rắn kết tinh từ trạng thái hơi bão hòa để làm sạch vật liệu, thường được gọi là quá trình “thăng hoa”. Trên thực tế, quá trình tinh luyện này được chia thành hai giai đoạn: giai đoạn chất rắn chuyển trực tiếp thành khí (thăng hoa) và giai đoạn khí chuyển hóa thành tinh thể.
Nhiều hợp chất hữu cơ và vô cơ có thể được tinh chế bằng cách thăng hoa. Ví dụ: iốt, lưu huỳnh, canxi, magiê, alcl3, fecl3 và các nguyên tố và hợp chất vô cơ khác, 2-aminophenol, naphtalen, anthracen, anhydrit phthalic, axit anthranilic, anthraquinon, phthalimide, axit benzoic axit, axit salicylic, caffeine và các chất hữu cơ khác hợp chất …
Nhiều loại thuốc cũng có thể được thanh lọc bằng phương pháp này, chẳng hạn như aspirin, long não …
Sự thăng hoa của nước đóng một vai trò quan trọng trong quá trình đông khô và được sử dụng rộng rãi trong sản xuất dược phẩm và các sản phẩm sinh học.
2.1. Nguyên tắc cơ bản của phương pháp
Cơ chế của quá trình thăng hoa được biểu diễn trên giản đồ pha biểu diễn trạng thái của vật chất bằng mối quan hệ giữa nhiệt độ và áp suất mà vật chất tồn tại (Hình 5.9). Giản đồ pha được chia thành ba vùng rắn, lỏng và hơi bằng các đường thăng hoa, bay hơi và hóa lỏng.
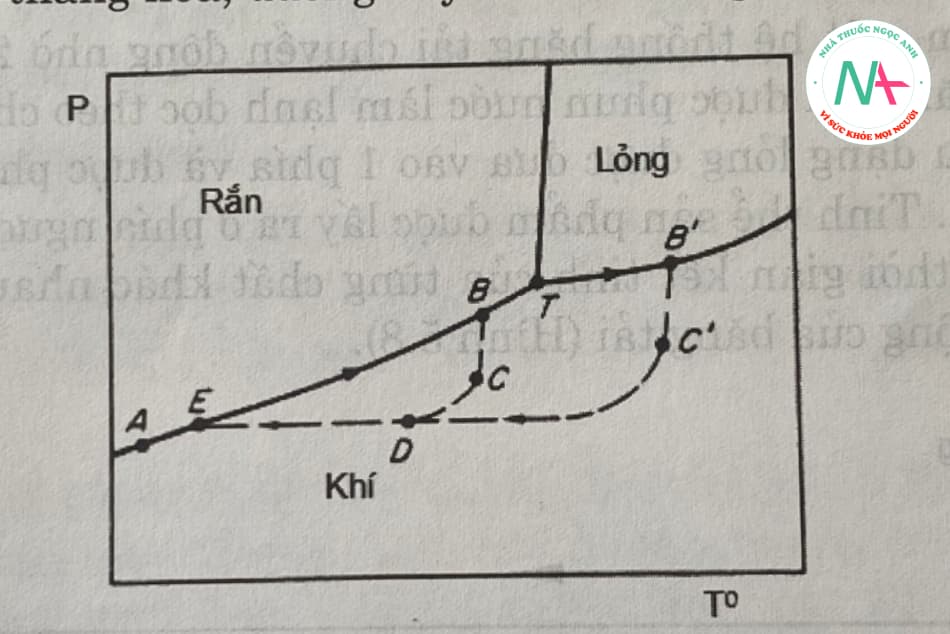
Ba đường cong cắt nhau tại điểm T (điểm cân bằng ba pha, còn gọi là điểm ba trạng thái). Nếu vị trí của điểm T nằm phía trên áp suất khí quyển thì chất răn không thể làm tan chảy trong điều kiện bình thường mà nó dễ dàng thăng hoa. Nếu điểm T ở phía thấp hơn áp suất khí quyển thì các quá trình thăng hoa hoặc ngưng tụ phải được kiểm soát.
Trong công nghiệp, người ta thường hóa lỏng các chất trước giai đoạn bay hơi để tạo điều kiện truyền nhiệt tốt hơn. Tuy nhiên, kết tinh ở giai đoạn này không được khuyến khích. Vì vậy thiết bị thăng hoa phải hoạt động dưới ba điểm. Sự hóa lỏng của các chất trước khi bay hơi được gọi là sự thăng hoa giả.
Hình 5.9 mô tả các chu kỳ thăng hoa và giả thăng hoa. Sự thăng hoa thực sự xảy ra khi áp suất của một chất ở điểm ba lớn hơn áp suất khí quyển. Một vòng lặp hoàn chỉnh được biểu diễn bằng dòng abcde. Áp suất hơi của chất rắn a tăng dọc theo đường thăng hoa từ a đến b khi nung đến nhiệt độ ở điểm b. Tại b, sự thăng hoa hoàn toàn.
Sự ngưng tụ của quá trình này được thể hiện dưới dạng bcde vì hơi rời khỏi thiết bị bay hơi và đi vào thiết bị ngưng tụ. Trong hình, điểm c đại diện cho áp suất và nhiệt độ ở đầu vào của bình ngưng. Ở đó, hơi nước có thể được làm mát hoặc pha loãng bằng không khí. Tại điểm c, nhiệt độ và áp suất hơi thấp hơn điểm b. Sau khi đi vào bình ngưng, hơi nước tiếp tục trộn với không khí và áp suất và nhiệt độ riêng phần của nó sẽ giảm xuống điểm d. Sau đó hơi nước được làm lạnh dưới áp suất không đổi đến điểm e, nhiệt độ của bình ngưng. Ở giai đoạn này, quá trình kết tinh đã hoàn tất.
Khi điểm ba của một chất ở áp suất thấp hơn áp suất khí quyển, thì khi nung nóng chất này dễ đạt đến một nhiệt độ nhất định và áp suất hơi vượt quá điểm ba. Chất rắn sau đó sẽ tan chảy trong thiết bị bay hơi (đường ab ‘được hiển thị, đoạn tb’). Tại b ‘, quá trình hóa hơi xảy ra hoàn toàn. Giảm áp suất riêng phần đến điểm thứ ba dưới c ‘(đầu vào bình ngưng) và sau đó ngưng tụ theo đường c’de tương tự như trên.
Thăng hoa theo từng đoạn
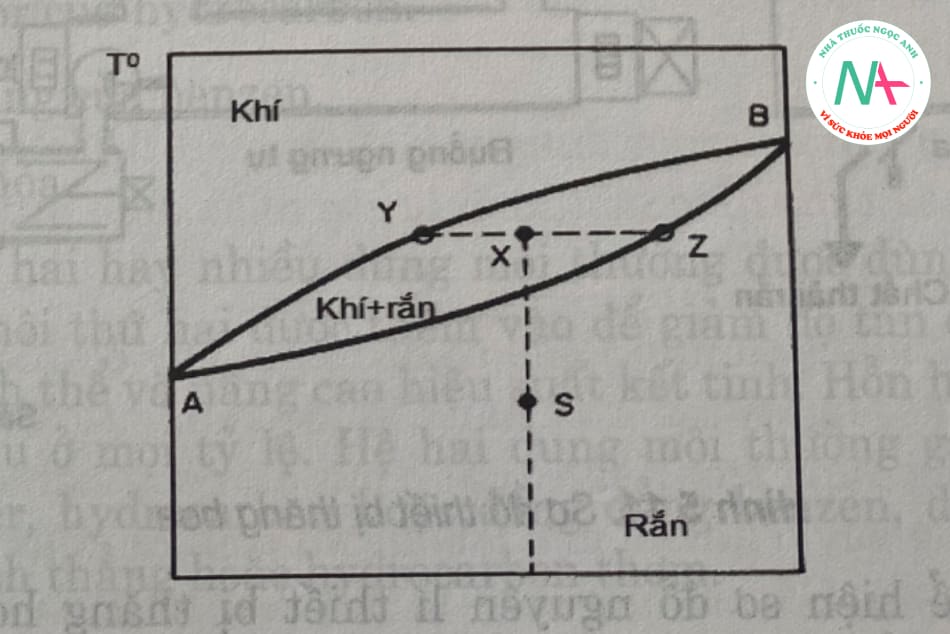
Nếu hai hoặc nhiều chất tạo thành một dung dịch rắn, về mặt lý thuyết, hai hoặc nhiều chất có thể được phân tách bằng cách thăng hoa phân đoạn. Biểu đồ pha của hệ thống nhị phân có áp suất dưới áp suất điểm ba được thể hiện trong Hình 5.10.
Điểm a và b lần lượt là nhiệt độ thăng hoa của các thành phần a và b tinh khiết (dễ bay hơi hơn). Đường cong dưới azb là đường cong thăng hoa của hỗn hợp a và b, và đường cong trên bya là đường đông đặc. Khi đun nóng dung dịch rắn có thành phần s đến nhiệt độ x, nó sẽ thăng hoa và pha khí ở y sẽ giàu thành phần hơn a và pha rắn ở z sẽ bị cô cạn trong a. Một chất tinh khiết có thể thu được bằng cách thăng hoa nhiều lần dung dịch rắn thu được kết quả như trên.
2.2. Các phương pháp thăng hoa
Kỹ thuật thăng hoa có thể được chia thành ba loại cơ bản: thăng hoa đơn giản, thăng hoa giảm áp suất và thăng hoa bằng quạt gió.
+ Thăng hoa đơn giản:
Vật liệu rắn được đốt nóng và hóa hơi, đồng thời hơi khuếch tán về phía bình ngưng. Động học khuếch tán là do sự chênh lệch áp suất giữa thiết bị bay hơi và thiết bị ngưng tụ. Đường dẫn hơi giữa dàn bay hơi và dàn ngưng phải ngắn để giảm sức cản của dòng chảy.
+ Thăng hoa Giải nén:
Tương tự như thăng hoa đơn giản, ngoại trừ pha hơi từ thiết bị bay hơi đến bình ngưng được thực hiện dễ dàng hơn bằng cách giảm áp suất trong bình ngưng. Khí thoát ra từ bình ngưng đi qua xyclon, tránh thất thoát sản phẩm.
+ Thổi bay thăng hoa:
Pha khí được chuyển từ buồng hóa hơi sang bình ngưng nhờ dòng khí trơ. Có thể dùng hơi nước quá nhiệt (chứa các chất không tan trong nước), không khí nóng, n2 hoặc co2. Ưu điểm của phương pháp này là tăng tốc độ di chuyển của pha khí vào bình ngưng. Ngoài ra, phương pháp này còn có thể cung cấp nhiệt cho quá trình thăng hoa khi sử dụng hơi nước hoặc khí nóng.
2.3. Kết tinh thiết bị thăng hoa
Hình 5.11 thể hiện sơ đồ nguyên lí thiết bị thăng hoa kết hợp cả 3 phương pháp có thê sử dụng là thăng hoa đơn giản, thăng hoa ở áp suất giảm và thăng hoa nhờ thổi khí. Trường hợp thăng hoa đơn giản thì không sử dụng các van chân không hoặc nitơ. Trường hợp thăng hoa ở áp suất giảm thì dùng thiết bị tạo chân không và mở các van chân không nối với thiết bị thăng hoa. Còn trường hợp thăng hoa nhờ thổi khí thì mở các van khí nitơ đê thổi hơi chất cần tinh che từ buồng hóa hơi đến thiết bị ngưng tụ.
3. Kết tinh từ dung dịch
Đây là một phương pháp kết tinh dựa trên sự hòa tan khác nhau của các chất rắn trong dung môi ở các nhiệt độ khác nhau, ở một nhiệt độ nhất định, dung dịch chứa nhiều chất tan nhất được gọi là dung dịch. bão hòa ở nhiệt độ này. Khi một dung dịch quá bão hòa, các chất tan dư được loại bỏ khỏi dung dịch ở dạng tinh khiết. Nó được phân lập bằng cách lọc, ly tâm hoặc lắng và gạn. Do nước mẹ chưa đạt đến nồng độ siêu bão hòa nên còn chứa một số chất cần lọc và các tạp chất khác.
Trong ngành công nghiệp dược phẩm, kết tinh từ dung dịch là một phương pháp tinh chế được sử dụng trong hầu hết các quy trình để tinh chế chất rắn nhằm thu được các sản phẩm đáp ứng các tiêu chuẩn dược phẩm.
3.1. Lựa chọn dung môi kết tinh
Việc lựa chọn dung môi trong quá trình kết tinh không phải là một việc dễ dàng. Từ các thí nghiệm trước đó, nhiều yếu tố dung môi cần được xem xét cẩn thận trước khi có thể lựa chọn hoặc loại bỏ chúng. Trong số hàng trăm chất lỏng được sử dụng làm dung môi trong phòng thí nghiệm, chỉ có vài chục hoặc thậm chí một vài dung môi có thể được sử dụng trong sản xuất. Dung môi được sử dụng trong kỹ thuật kết tinh chủ yếu bao gồm các loại sau:
- Axit axetic và các dẫn xuất este của nó.
- Cồn và xeton.
- Ester.
- Các dẫn xuất của clo
- Các chất tương tự
- Ete dầu mỏ …
Một hỗn hợp của hai hoặc nhiều dung môi thường được sử dụng trong quá trình kết tinh. Một dung môi thứ hai được thêm vào để giảm độ tan của chất tan, tạo mầm tinh thể và tăng hiệu quả kết tinh. Hỗn hợp dung môi cần được hòa tan theo mọi tỷ lệ. Hệ thống hai dung môi phổ biến bao gồm các dẫn xuất clo hóa của rượu với nước, xeton, este, hydrocacbon hoặc đồng đẳng benzen, hydrocacbon mạch thẳng hoặc thơm.
Hãy cẩn thận khi chọn dung môi cho quá trình kết tinh: chất cần kết tinh phải dễ hòa tan trong dung môi và dễ kết tinh khi làm lạnh hoặc bay hơi. Dựa trên phân cực, dung môi có thể được phân loại là phân cực hoặc không phân cực. Các chất tan không phân cực thường tan trong dung môi không phân cực, ít hoặc không tan trong dung môi phân cực và ngược lại. Không nên sử dụng các dung môi tương tự về mặt hóa học với chất tan vì tính hòa tan lẫn nhau cao và kết tinh khó hoặc không kinh tế. Cần lưu ý rằng dạng tinh thể có thể bị thay đổi bằng cách thay đổi dung môi kết tinh. Theo tính chất tương tác của các liên kết nội phân tử của dung môi, chúng có thể được chia thành ba loại:
1) Dung môi protic phân cực: nước, metanol, axit axetic.
2) Dung môi aprotic lưỡng cực: nitrobenzene, acetonitril,
3) Dung môi không phân cực aprotic: hexan, benzen, ete.
Trong dung môi protic phân cực, các liên kết hydro mạnh được hình thành giữa các phân tử dung môi. Để có thể hòa tan, chất hòa tan cũng phải có khả năng tạo liên kết hydro với dung môi. Đối với aprotic hoặc các chất hòa tan về cơ bản không tạo liên kết mạnh với các phân tử dung môi, độ hòa tan có thể rất thấp.
Trong dung môi aprotic lưỡng cực, các phân tử dung môi tương tác với nhau thông qua tương tác lưỡng cực-lưỡng cực. Nếu chất tan cũng là proton-lưỡng cực, nó sẽ tương tác với các phân tử dung môi theo kiểu lưỡng cực-lưỡng cực và hòa tan trong loại dung môi này. Nếu chất tan không phân cực, nó không thể tương tác với các phân tử dung môi và do đó không thể hòa tan. Chất tan protic có thể hòa tan trong dung môi aprotic lưỡng cực vì liên kết hydro có thể hình thành giữa chất tan và phân tử dung môi.
Trong dung môi aprotic, không phân cực, tương tác giữa các phân tử chỉ là lực van der Waals yếu. Các chất tan không phân cực dễ hòa tan, trong khi các chất tan proton hóa phân cực hoặc lưỡng cực hầu như không hòa tan.
Độ hòa tan của dung môi được biểu thị bằng khối lượng của một chất có thể được hòa tan trong một thể tích dung môi nguyên chất nhất định ở một nhiệt độ nhất định.
Hầu hết các dung môi (trừ nước) đều độc hại, gây ô nhiễm môi trường và gây cháy nổ. Vì vậy, ngoài khả năng tan, sự thay đổi độ tan theo nhiệt độ… Khi ứng dụng trong sản xuất công nghiệp cần chú ý đến tính độc hại, khả năng gây ô nhiễm môi trường và dễ cháy nổ. Sự nổ của dung môi dùng để kết tinh, các biện pháp thông gió trong phân xưởng sản xuất cần được nghiên cứu kỹ về giới hạn nổ của từng loại. Hiện nay, nhiều dược khoa đã thiết lập các tiêu chuẩn về dư lượng dung môi trong nguyên liệu dược phẩm và hóa chất. Nhiều quốc gia đã cấm một số dung môi độc hại, gây ung thư, chẳng hạn như benzen. Dung môi là clo hữu cơ có khả năng gây ô nhiễm môi trường cao. Ete dễ bay hơi và dễ cháy.
Dung môi phải ổn định trong mọi điều kiện vận hành để kết tinh và phục hồi. Không dễ phân hủy và không dễ bị oxy hóa.
Không được xảy ra phản ứng hóa học giữa chất tan và dung môi, nhưng có thể có một số tương tác vật lý như quá trình hòa tan. Các dung môi có độ nhớt cao thường không thuận lợi cho quá trình kết tinh, gây khó khăn cho quá trình lọc và rửa. Do đó, dung môi có độ nhớt thấp được ưu tiên hơn.
Quá trình thu hồi dung môi bằng cách chưng cất phải dễ thực hiện và cần tính đến sự thất thoát dung môi trong quá trình lọc và đun nóng để tiết kiệm và không nguy hiểm.
3.2. Dung dịch hòa tan và bão hòa
Mỗi chất có khả năng hòa tan khác nhau trong các dung môi khác nhau. Độ hòa tan phụ thuộc vào bản chất hóa học của chất, bản chất của dung môi và nhiệt độ. Đối với hầu hết các chất, độ tan tăng khi nhiệt độ tăng. Tuy nhiên, trong một số trường hợp, độ tan giảm khi tăng nhiệt độ.
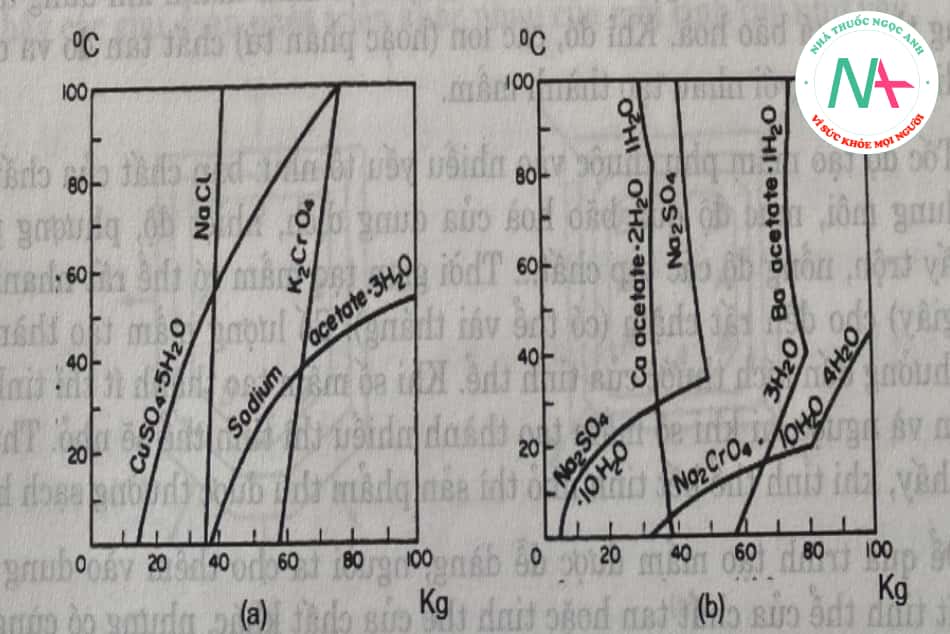
Độ hòa tan của một chất thường được xác định bằng thực nghiệm và được biểu thị dưới dạng đường cong phụ thuộc giữa độ hòa tan và nhiệt độ. Hình 5.12 cho thấy kg muối hòa tan trong 100 kg nước ở các nhiệt độ khác nhau. Trong hầu hết các chất, cấu hình hòa tan ổn định (Hình 5.12a). Đối với các chất kết tinh ngậm nước, có một điểm đứt gãy đối với đường hòa tan, chứng tỏ trạng thái kết tinh có sự thay đổi (Hình 5.12b).
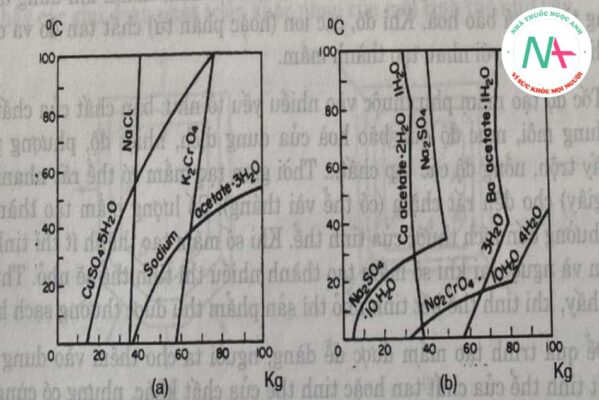
Trên sơ đồ ta thấy, NaCl có độ tan tăng rất ít khi tăng nhiệt độ, natri acetat có độ tan tăng mạnh khi tăng nhiệt độ. Dựa vào độ tan của từng chất trong các dung môi để lựa chọn phương pháp kết tinh hợp lí, điều này sẽ được làm rõ hơn ở phần sau. Natri sulfat khan, calci sulfatkhan độ tan giảm khi tăng nhiệt độ, sự kết tinh của các muối này ở nhiệt độ cao gây khó khăn cho quá trình truyền nhiệt là điều cần được chú ý.
Dung dịch bão hòa là dung dịch chứa nhiều chất tan nhất ở nhiệt độ nhất định. Trong một dung dịch bão hòa, các tinh thể và dung dịch ở trạng thái cân bằng động, có nghĩa là cứ một tinh thể mới được hình thành thì càng nhiều tinh thể hòa tan vào dung dịch càng tốt.
Sự kết tinh chỉ xảy ra khi dung dịch quá bão hòa. Ở trạng thái này, dung dịch thường không bền, chất tan dư sẽ kết tinh, và dung dịch dần trở lại trạng thái bão hòa.
Để thực hiện quá trình kết tinh, một dung dịch siêu bão hòa phải được tạo ra. Bạn có thể sử dụng các phương pháp sau:
-Sự làm lạnh bằng dung dịch: đối với những chất có độ tan tăng theo nhiệt độ.
– Chưng cất: dùng cho các chất mà độ tan của chúng không thay đổi khi nhiệt độ tăng.
3.3. Sự hình thành tinh thể
Sự hình thành tinh thể bao gồm hai giai đoạn: giai đoạn tạo mầm tinh thể và giai đoạn tạo mầm tinh thể phát triển thành một tinh thể hoàn chỉnh.
3.3.1. Quá trình tạo hạt nhân
Hạt nhân tinh thể (còn gọi là tâm tinh thể) hình thành khi dung dịch ở trạng thái siêu bão hòa. Sau đó, các ion (hoặc phân tử) chất tan liên kết với nhau thông qua va chạm để tạo thành hạt nhân nguyên tử.
Tốc độ tạo mầm phụ thuộc vào nhiều yếu tố như: bản chất của chất tan và dung môi, độ siêu bão hòa của dung dịch, nhiệt độ, cách pha trộn, nồng độ tạp chất … Quá trình nảy mầm có thể rất nhanh (từ vài giây) đến rất chậm. (có thể vài giây) tháng). Số lượng hạt nhân được hình thành ảnh hưởng đến kích thước của tinh thể. Khi số lượng nhân hình thành ít thì tinh thể sẽ lớn, ngược lại khi số lượng chồi nhiều thì tinh thể sẽ nhỏ. Trên thực tế, khi các tinh thể nhỏ hơn, sản phẩm thường sạch hơn.
Để thúc đẩy quá trình tạo mầm, một số tinh thể của chất tan hoặc tinh thể của chất khác được thêm vào dung dịch, nhưng có cùng cấu trúc tinh thể với chất tan trong dung dịch. Các chất được thêm vào được gọi là “chất hỗ trợ vi khuẩn”. Biện pháp này đặc biệt cần thiết đối với các dung dịch khó tạo mầm khi dung dịch có mức độ siêu bão hòa rất cao.
Để tạo điều kiện thuận lợi cho quá trình tạo mầm, người ta còn có thể thay đổi nhiệt độ, tăng kích động, tăng cường các tác dụng cơ học bên ngoài (rung, lắc, chấn động …). Độ nhám của bề mặt kết tinh và vật liệu khuấy cũng ảnh hưởng đến quá trình tạo mầm.
3.3.2. Tăng trưởng tinh thể
Một tinh thể phát triển dọc theo tất cả các mặt của nó, tuy nhiên, tùy thuộc vào điều kiện kết tinh, tốc độ phát triển của các mặt tinh thể là khác nhau. Các tinh thể của vật chất có thể có các kích thước khác nhau. Sự tăng trưởng tinh thể có nhiều cách giải thích, sau đây là một số ví dụ.
3.3.2.1. Theo thuyết năng lượng bề mặt
Một giọt chất lỏng ổn định khi sức căng bề mặt và diện tích bề mặt nhỏ nhất. Gibbs gợi ý rằng sự phát triển của tinh thể có thể được coi là một trường hợp đặc biệt của nguyên lý này: khi hằng số nhiệt độ và áp suất là nhỏ nhất, tổng năng lượng tự do của tinh thể cân bằng với môi trường xung quanh nó. Do đó, đối với các tinh thể được nuôi cấy trong dung dịch siêu bão hòa, cần đảm bảo tổng năng lượng bề mặt tự do tối thiểu cho một khối lượng nhất định.
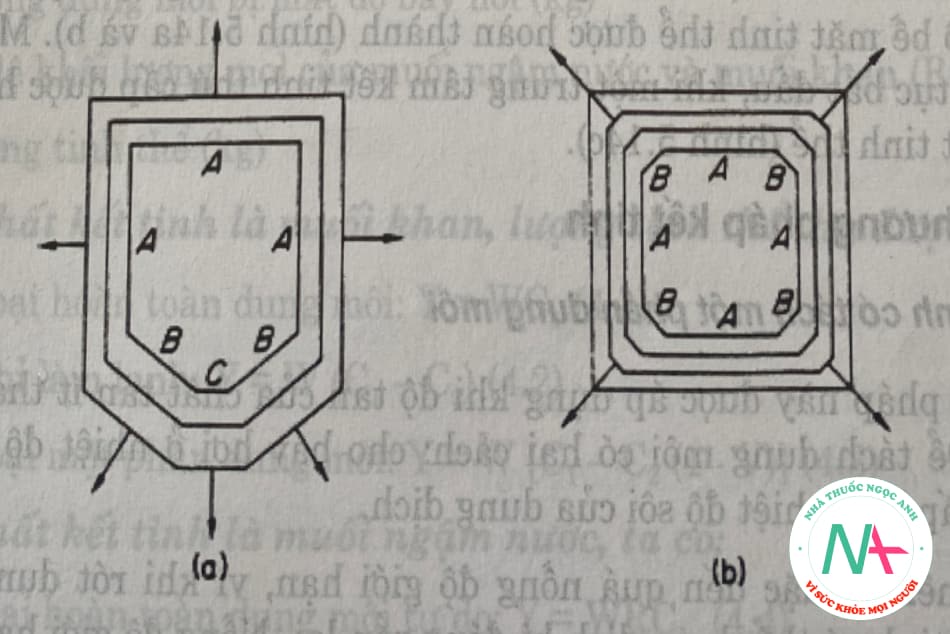
Hình 5.13a cho thấy tình huống lý tưởng mà tinh thể vẫn giữ được hình dạng của nó trong quá trình tăng trưởng. Tinh thể này được cho là “bất biến” khi kết tinh. Ba cạnh a phát triển cùng tốc độ; cạnh nhỏ b phát triển nhanh hơn và cạnh nhỏ nhất c phát triển nhanh nhất. Ngược lại, khi tinh thể này tan ra thì mặt c sẽ tan nhanh hơn các mặt còn lại.
Trên thực tế, đây không phải là trường hợp của sự phát triển tinh thể. Khuôn mặt nhỏ hơn phát triển nhanh hơn, nhưng đến một lúc nào đó nó cũng biến mất. Hình 4.13b cho thấy các giai đoạn phát triển khác nhau của tinh thể này.
3.3.2.2. Theo lí thuyết hấp phụ
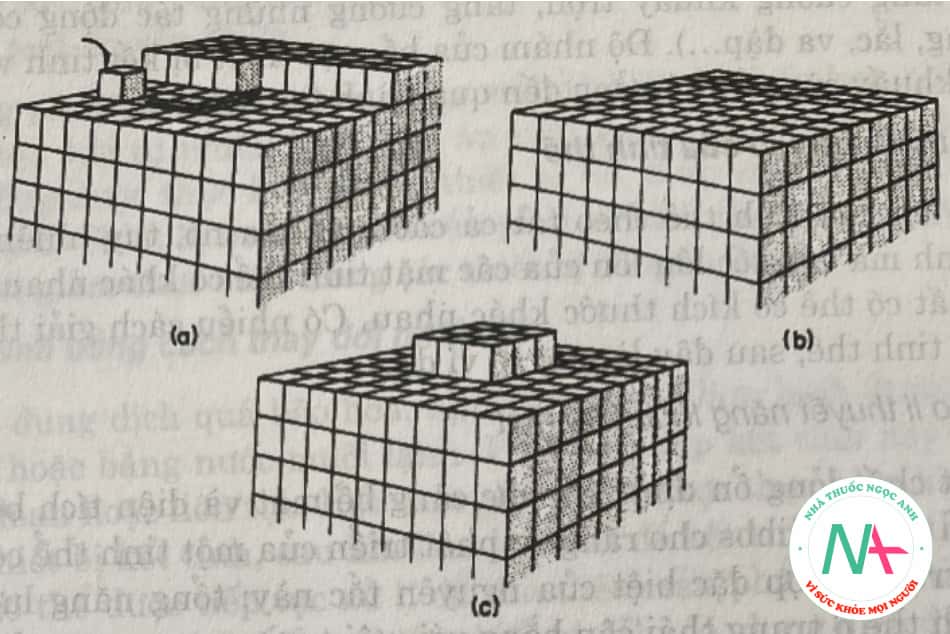
Cơ chế lớn lên của tinh thể dựa trên cơ sỏ một lốp hấp phụ nguyên tử hay phân tử chất tan tồn tại trên bề mặt tinh thể (Volmer-1939). Khi chất tan khuếch tán đến bề mặt tinh thể, nó không tích hợp vào mạng tinh thể ngay. Một trạng thái cân bằng động được thiết lập tạo thành 1 lớp giữa dung dịch và tinh thể. Lớp này được gọi là lớp hấp phụ, nó đóng một vai trò quan trọng trong sự lớn lên của tinh thể và tạo mầm thứ cấp. Độ dày của lớp hấp phụ không vượt quá 10nm, thậm chí chỉ gần 1 nm.
Các nguyên tử, ion hoặc phân tử sẽ liên kết với mạng tinh thể ở những vị trí có trọng lực cao (trung tâm hoạt động). Chúng tự sắp xếp cho đến khi toàn bộ bề mặt tinh thể hoàn chỉnh (Hình 5.14a và b). Một lớp mới có thể tiếp tục bắt đầu vì một trung tâm kết tinh thứ cấp được hình thành trên bề mặt tinh thể (Hình 5.14c).
3.4. Phương pháp kết tinh
3.4.1. Tách và kết tinh một phần dung môi
Phương pháp này phù hợp với trường hợp độ tan của chất tan không thay đổi nhiều theo nhiệt độ. Dung môi được tách ra theo hai cách: bay hơi ở nhiệt độ sôi hoặc ở nhiệt độ thấp hơn nhiệt độ sôi của dung dịch.
Không nên cô đặc đến mức giới hạn vì đổ dung dịch vào thiết bị kết tinh sẽ làm cho dung dịch đông đặc. Nồng độ giới hạn của mỗi chất được xác định bằng thực nghiệm.
Nhược điểm của phương pháp này là nồng độ tạp chất cũng tăng lên sẽ kết tinh với sản phẩm. Nếu không, các tinh thể sẽ dính hoặc đóng cặn trên bề mặt truyền nhiệt.
Phương pháp tách một phần dung môi bằng bay hơi tự phát hoặc bay hơi dưới áp suất giảm ở nhiệt độ thấp hơn nhiệt độ sôi của dung môi. Phương pháp bay hơi tự nhiên thường tiến hành trong thiết bị hở, dưới áp suất thường, thời gian bay hơi chậm. Thiết bị bay hơi cần có kích thước lớn. Phương pháp ngưng tụ giải nén được thực hiện trong thiết bị đặc biệt.
3.4.2. Kết tinh bằng cách thay đổi nhiệt độ
Để chuẩn bị một dung dịch quá bão hòa, dung dịch có thể được làm lạnh bằng nước lạnh hoặc nước muối lạnh. Phương pháp kết tinh này có thể hoạt động theo từng đợt hoặc liên tục. Quá trình kết tinh gián đoạn được thực hiện khi dung dịch được thêm vào máy kết tinh, kết tinh sau khi làm nguội, và các tinh thể được lọc. Nước mẹ có thể được chế biến thêm để thu được nhiều sản phẩm hơn. Quá trình kết tinh liên tục được thực hiện trong một hệ thống nhiều thiết bị. Sau đó, dung dịch được thêm vào liên tục trong khi sản phẩm và nước được rút ra liên tục.
3.5. Tính hiệu suất kết tinh lý thuyết
Nếu dữ liệu về chất tan và dung môi được biết trước, thì hiệu quả kết tinh có thể được tính bằng cách làm lạnh hoặc làm bay hơi dung môi. Chúng tôi xem xét các tình huống sau:
Biểu tượng:
c1: nồng độ dung dịch ban đầu (kg muối khan / kg dung môi)
c2: Nồng độ dung dịch cuối cùng (kg muối khan / kg dung môi)
w: khối lượng dung môi ban đầu (kg)
v: Lượng dung môi bị mất do bay hơi (kg)
r: tỷ lệ khối lượng mol của muối ngậm nước và muối khan (r = mn / mk)
y: Lượng kết tinh (kg)
Dùng muối khan kết tinh, lượng tinh thể thu được như sau:
Nếu dung môi được loại bỏ hoàn toàn: y = wc1 (4.1)
Nếu chỉ làm mát: y = w (c1 – c2) (4.2)
Nếu loại bỏ một phần dung môi: y = w [c1-c2 (1-v)] (4.3)
Các chất kết tinh là muối ngậm nước, chúng ta có:
Chỉ định dung môi hoàn toàn tự do: y = wrc1 (4.4)
Nếu chỉ làm mát: y = [wr (c1 – c2)] / [1-c2 (r-1)] (4,5)
Nếu loại bỏ một phần dung môi: y = [wr (c1 – c2 (1-v))] / [1-c2 (r-1)] (4.6)
Ví dụ 1:
Tính khối lượng tinh thể nguyên chất thu được từ dung dịch chứa 100 kg natri sunfat (m = 142) trong 500 kg nước, làm lạnh đến 10 ° C. Độ tan của natri sunfat ở 10 ° C là 9 kg muối khan trong 100 kg nước. Tinh thể thu được là 10 phân tử nước (m = 322). Giả sử rằng 2% lượng nước bị mất do bay hơi trong quá trình làm lạnh.
Hiệu suất kết tinh được tính như sau:
r = 322/142 = 2,27
c1 = 0,2 kg na2so4 / kg nước
c2 = 0,09 kg na2so4 / kg nước
w = 500 kg nước
v = 0,02 kg / kg nước ban đầu
Thay các giá trị vào phương trình (4.6), chúng ta có:
y = {500 x 2,27 [0,2 – 0,09 (1 – 0,02)]} / [1 -0,09 (2,27-1)] = 1,43
Theo cách này, tinh thể na2so4.10h2o thu được là 143 kg.
Trong quá trình bay hơi và kết tinh dung môi trong chân không, để xác định lượng vật liệu kết tinh cần tính lượng v dung môi bay hơi trong thiết bị. Nó phụ thuộc vào nhiệt lượng cần cung cấp, nhiệt kết tinh, nhiệt độ đầu và cuối của dung dịch … Cân bằng nhiệt được tính như sau:
vwλv = c (t1- t2) w (1 – c0 + c y (4,7)
Vị trí:
λv: entanpi bay hơi của dung môi (kj / kg)
λc: nhiệt kết tinh của sản phẩm (kj / kg)
t1: Nhiệt độ ban đầu của dung môi (° c)
t2: Nhiệt độ cuối của dung môi (° c)
c: nhiệt dung riêng của dung dịch (kj /kg.degrees)
Thay y từ phương trình (4.6) thành (4.7) và đơn giản hóa, chúng ta có:
v = {λcr (c1- c2) + c (t1- t2) (1 + c1) [1 – c2 (r – 1)]} / {λv [1-c2 (r-1)] – λcrc2 } (4,8)
Ví dụ 2:
Tính khối lượng tinh thể natri axetat (ch3coona 3h20) thu được khi thực hiện kết tinh chân không liên tục. Biết áp suất của thiết bị bay hơi là 15 mbar, tốc độ dung dịch vào thiết bị là 2000 kg / h, nồng độ của dung dịch là 40% (0,4 kg muối natri axit axetic khan trong 0,6 kg nước), và nhiệt độ là 80 ° C. Nhiệt độ sôi của dung dịch tăng 11,5 ° C.
Nhiệt độ kết tinh của ch3coona là 3h20, λc = 144 kj / kg
Nhiệt dung riêng của dung dịch, c = 3,5 kj / kg.degrees
Hóa hơi entanpi của nước ở 15 mbar, λv = 2,46 mj / kg
Điểm sôi của nước ở 15 mbar = 17,5 ° c
Nhiệt độ hoạt động = 17,5 + 11,5 ° c = 29 ° c
Độ hòa tan ở 29 ° C, c2 = 0,539 kg / kg
Nồng độ ban đầu, c1 = 0,4 / 0,6 = 0,667 kg / kg
Khối lượng ban đầu của nước trong dung dịch, w = 0,6 x2000 = 1200 kg / h. Tỷ lệ khối lượng mol, r = 136/82 = 1,66
Tính lượng nước bay hơi bằng cách thay các giá trị đã xác định vào phương trình (4.8): v = 0,153 kg / kg lượng nước ban đầu.
Thay v = 0,153 vào công thức (4.6) để thu được lượng tinh thể natri axetat trihydrat y = 660 kg / h.
3.6. Thiết bị kết tinh
3.6.1. Máy kết tinh đậm đặc
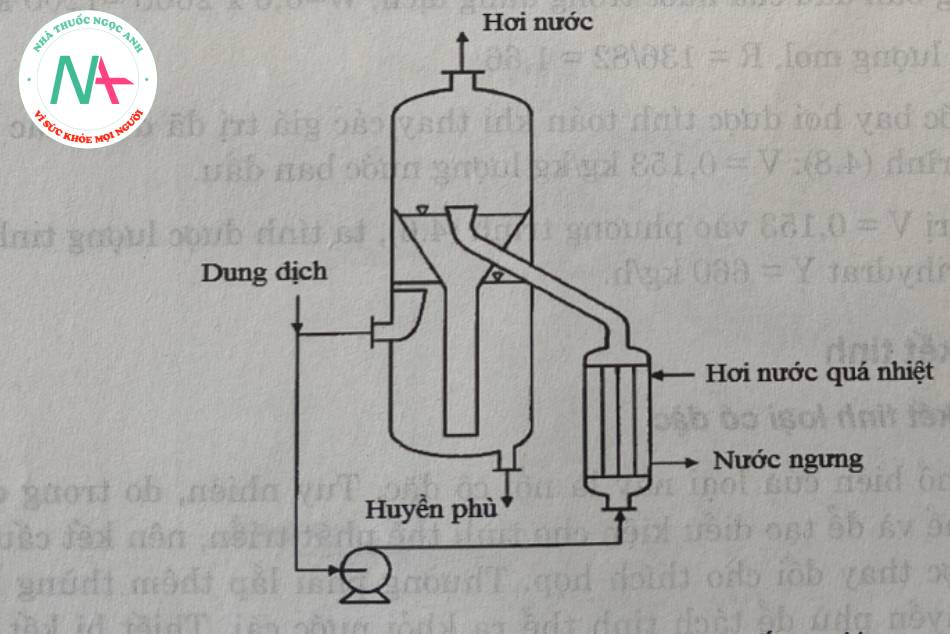
Một thiết bị phổ biến thuộc loại này là bộ tập trung. Tuy nhiên, do sự có mặt của các tinh thể trong dung dịch, để thúc đẩy sự phát triển của tinh thể, cấu trúc của thiết bị cô đặc cũng được thay đổi tương ứng. Người ta thường lắp đặt bể lọc ở đầu ra của huyền phù để tách các tinh thể ra khỏi nước mẹ. Bộ kết tinh buồng đốt trong (Hình 5.15) và bộ kết tinh buồng đốt ngoài (Hình 5.16) là hai bộ kết tinh điển hình.
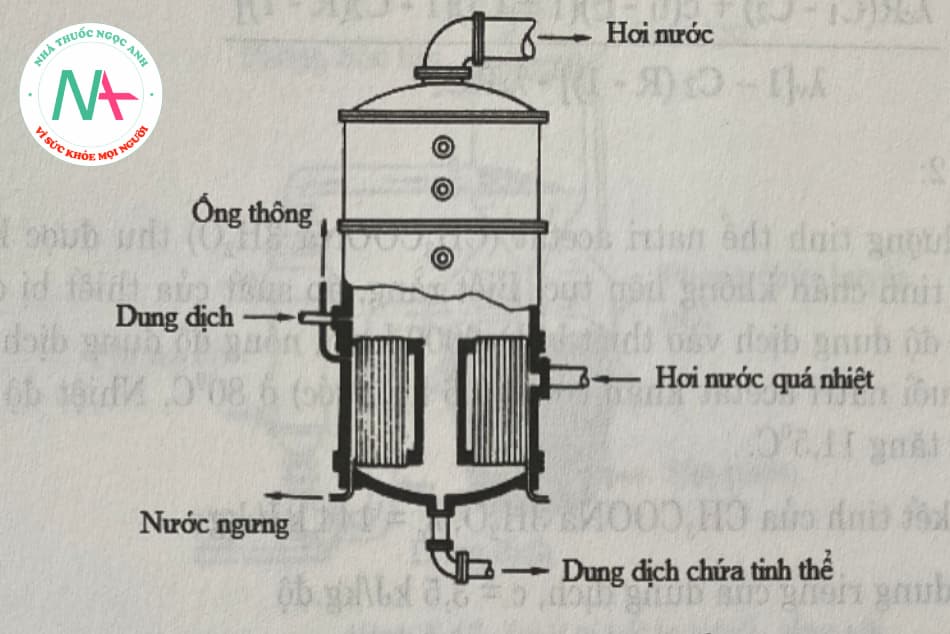
Các thiết bị được gia nhiệt bằng hơi nước quá nhiệt. Buồng đốt là loại ông ngắn, thẳng đứng. Trung tâm buồng đốt thường được lắp ống lốn, cho phép dung dịch dễ lưu thông. Với các dung dịch có độ nhốt cao, cần có biện pháp tuần hoàn cưỡng bức vối sự trợ giúp của bơm hoặc máy khuấy.
Sản phẩm thu được từ thiết bị này có kích thước tinh thể lớn và đồng đều.
3.6.2. Thiết bị kết tinh kiểu tầng sôi
Hình 5.17 là một sơ đồ của thiết bị kết tinh tầng sôi buồng đốt ngoài. Chất lỏng được chạy qua thiết bị bằng một máy bơm khối lượng lớn.
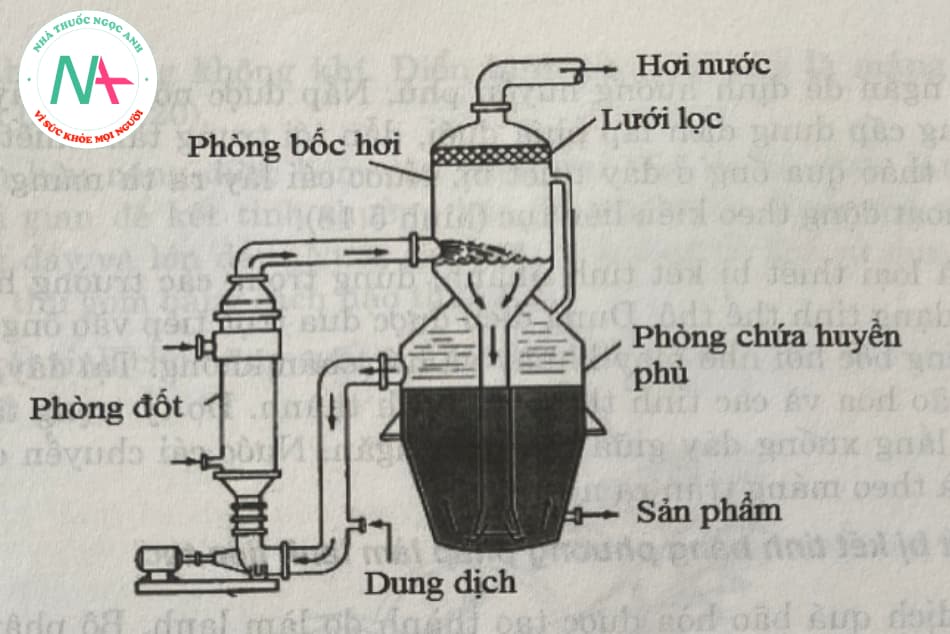
Dung dịch cần kết tinh được bơm qua bộ phận gia nhiệt đến sôi, sau đó được phun vào phòng bốc hơi. Tại đây, do phòng bốc hơi có dung tích lớn, dung dịch được bốc hơi kiểu tầng sôi. Hơi nước qua lưới lọc và đến bộ phận ngưng để thu hồi. Tinh thể tạo thành đủ lớn thì theo ông trung tâm lăng xuống đáy, huyền phù qua ống thông vào phòng chứa huyền phù để tiếp tục chu trình mối.
3.6.3. Máy kết tinh chân không kiểu dung môi
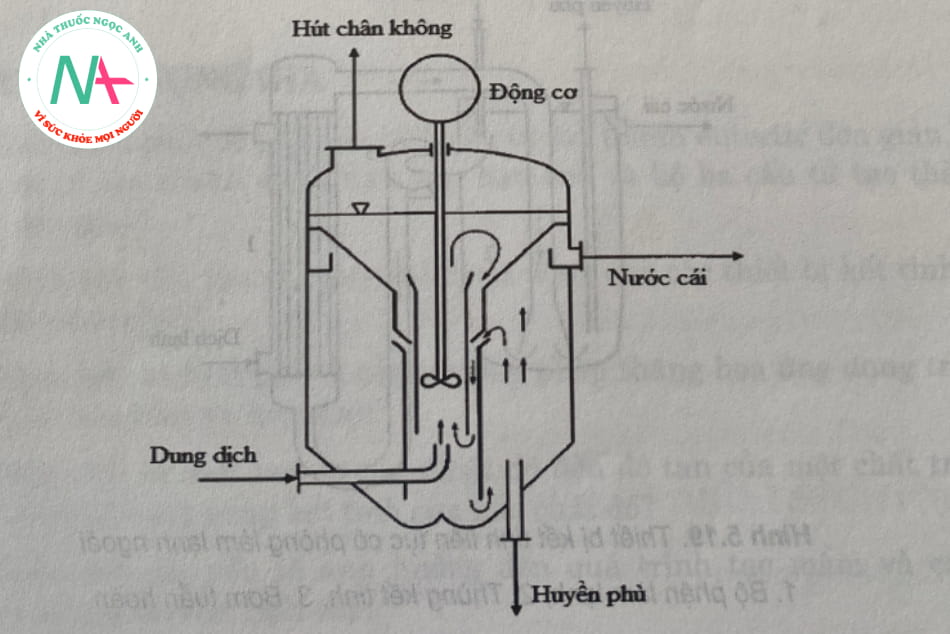
Thiết bị kết tinh loại dung môi ở áp suất giảm còn gọi là thiết bị kết tinh chân không. Cấu tạo thiết bị dạng hình trụ, có máy khuấy, phía trong có lắp các vách ngăn đê định hướng huyền phù. Nắp được nôi với máy hút chân không, ông cấp dung dịch lắp phía dưới, dẫn tới trung tâm thiết bị. Huyền phù được tháo qua ông ở đáy thiết bị. Nước cái lấy ra từ máng chảy tràn. Thiết bị hoạt động theo kiểu liên tục (hình 5.18).
Loại thiết bị kết tinh nhanh này được sử dụng khi chỉ yêu cầu các tinh thể thô. Dung dịch được đưa trực tiếp vào ống trung tâm và vùng bay hơi bằng máy khuấy và chân không. Tại đây, dung dịch trở nên quá bão hòa và hình thành các tinh thể. Do mật độ tăng, huyền phù lắng xuống đáy giữa các vách ngăn. Nước cái chảy ngược dòng và chảy ra theo máng.
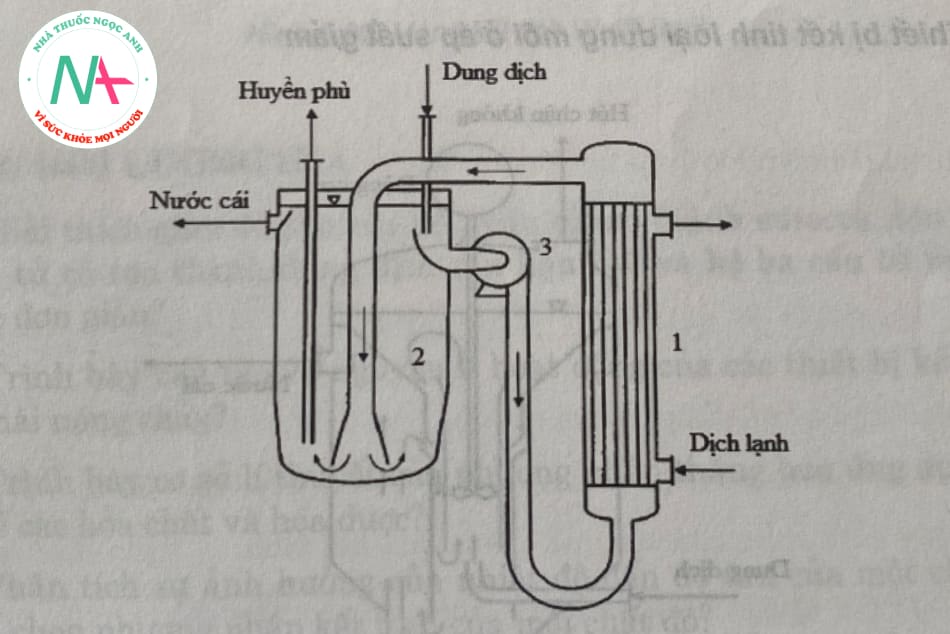
3.6.4. Thiết bị kết tinh làm mát liên tục
Làm nguội để tạo thành dung dịch quá bão hòa. Bộ phận làm lạnh lấy nhiệt từ dung dịch và làm nóng nó. Chất mang nhiệt có thể dùng nước lạnh hoặc hỗn hợp nước đá + muối.
Bể kết tinh là một cấu trúc hình trụ đứng, và bơm tuần hoàn 3 được sử dụng để đưa dung dịch vào bộ làm mát. Kích thước tinh thể tăng lên trong quá trình đạp xe. Khi các hạt đủ lớn để tách ra và lắng xuống đáy, chúng liên tục được hút ra ngoài. Nước mẹ sau khi qua bộ lọc được gom vào bể chứa rồi thoát ra ngoài.
3.6.5. Máng kết tinh
Đây là một thiết bị đơn giản chỉ bao gồm một khe kim loại được gắn trên hệ thống giá đỡ. Thiết bị để kết tinh các chất kết tinh chậm, làm mát tự nhiên bằng không khí. Một đại diện điển hình của loại này là bể kết tinh wulff-bock (Hình 5.20).
Vật liệu nóng được bơm vào bể chứa quặng và làm nguội tự nhiên, thời gian kết tinh thường kéo dài trong vài ngày. Các tinh thể sản phẩm lắng xuống đáy và trở nên lớn hơn. Nước máy được hút để tái sử dụng và sản phẩm được thu gom bằng cách nạo thủ công.
Bể kết tinh có hiệu suất sản xuất thấp, chi phí nhân công cao và không gian lắp đặt lớn.
Câu hỏi lượng giá
1. Giải thích sơ đồ pha của các hệ nhị phân tạo thành eutectics đơn giản, các hệ nhị phân tạo thành các nghiệm rắn hữu hạn và các hệ bậc ba tạo thành eutectics đơn giản?
2. Mô tả cấu tạo và nguyên lý làm việc của bộ máy kết tinh từ trạng thái nóng chảy?
3. Giới thiệu cơ sở lý thuyết về việc ứng dụng thăng hoa vào tinh chế hóa chất, hóa dược?
4. Trong việc lựa chọn phương pháp kết tinh cho từng chất, ảnh hưởng của nhiệt độ phân tích đến độ tan của chất đó?
5. Phân tích các yếu tố ảnh hưởng đến thuyết tạo mầm và tăng trưởng tinh thể?
6. Giới thiệu cấu tạo, nguyên lý làm việc, ưu nhược điểm của thiết bị kết tinh dung dịch?