Việc sử dụng sắt và hợp kim của sắt đã được biết đến từ thời cổ đại. Ngày nay, sắt vẫn là kim loại được sử dụng thường xuyên trong cuộc sống hàng ngày. Điều này là do sắt có các tính chất vật lý và hóa học đặc biệt. Vậy kim loại đen là gì? Nêu khái niệm, tính chất và ứng dụng của sắt trong đời sống? Hãy cùng khỉ tìm hiểu về nó nhé!
Khái niệm kim loại sắt
Sắt là một nguyên tố hóa học trong bảng tuần hoàn có ký hiệu fe, số hiệu nguyên tử 26, phân nhóm viiib, chu kỳ 4. Sắt có nhiều trên Trái đất và bao gồm các lớp vỏ và lõi.
.jpg)
-
Ký hiệu: fe.
Khối lượng nguyên tử: 56.
Mật độ: 7,86 g / cm³.
Điểm nóng chảy: 1539 ° C.
Khối lượng nguyên tử: 55,845u.
Số electron trong mỗi lớp vỏ lần lượt là: 2, 8, 14, 2.
Số nguyên tử: 26.
Tính chất vật lý của sắt
Sắt là một kim loại màu trắng, dẻo, dai và cực kỳ dễ rèn, có nhiệt độ nóng chảy khá cao là 1539 độ C. Sắt là chất dẫn nhiệt, dẫn điện và từ tính tốt.
Tính chất hóa học của sắt
Các tính chất hóa học của sắt là gì? Kim loại sắt có thể phản ứng với phi kim, axit, nước và muối để tạo thành hợp chất. Phản ứng hóa học của kim loại với các loại này, có hoặc không có chất xúc tác.

Hiệu ứng phi kim loại
Sắt phản ứng với hầu hết các phi kim loại khi đun nóng.
Sắt phản ứng với oxy: 3fe + 2o2 → fe3o4
fe3o4 là một oxit sắt từ, một oxit với hỗn hợp của sắt hóa trị II và iii: feo và fe2o3
Sắt phản ứng với các phi kim loại khác: 2fe + 3cl2 → 2fecl3
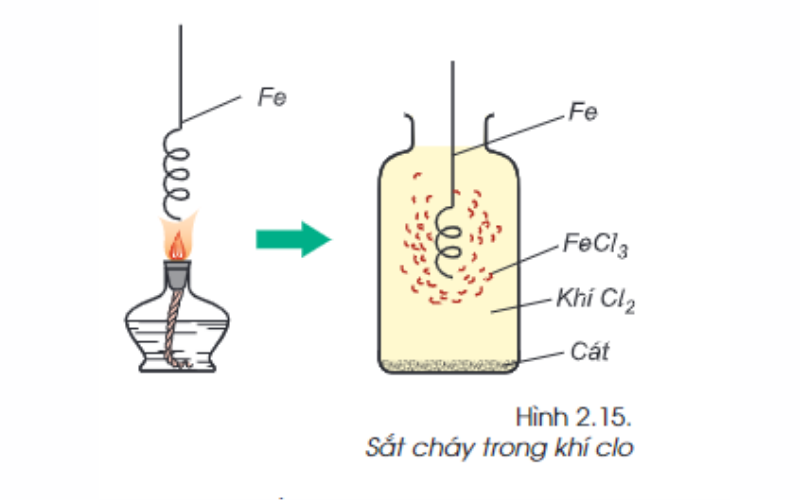
Ngoài oxi (o) và (các) lưu huỳnh, sắt có thể phản ứng với nhiều phi kim loại khác (ví dụ: cl2, br2 …) để tạo thành muối.
Phản ứng với axit
Sắt phản ứng với hcl, pha loãng h2s04 để tạo thành muối sắt (ii) và giải phóng h2:
fe + 2hcl (pha loãng) → fecl2 + h2 ↑
fe + 2h2so4 (chất pha loãng) → feso4 + h2 ↑
Lưu ý: Sắt (fe) không phản ứng với axit hno3 đặc nguội và axit h2s04 đặc nguội. Bởi vì ở nhiệt độ phòng, sắt tạo thành một lớp oxit bảo vệ kim loại không bị “thụ động hóa” và hòa tan.
Sắt phản ứng với axit nitric đặc nóng và axit sunfuric đặc nóng để tạo thành muối sắt iii:
2fe + 6h2so4 (rắn, nóng) → fe2 (so4) 3 + 3so2 + 6h2o
fe + 6hno3 (rắn, nóng) → fe (no3) 3 + 3no2 + 3h2o
Phản ứng với dung dịch muối
Khi kim loại sắt kết hợp với muối của kim loại yếu hơn, phản ứng tạo ra muối và kim loại mới.
fe + cuso4 → cu + feso4
Sử dụng nước
Khi kim loại đen phản ứng với nước, chỉ cần đun nóng đến nhiệt độ cao.
3fe + 4h2o → fe3o4 + 4h2 (<5700c)
fe + h2o → feo + h2 (> 5700c)
Làm thế nào để chuẩn bị sắt?
Sắt được sản xuất bằng phương pháp nhiệt luyện. Các hợp chất sắt bị khử bằng cách sử dụng các chất khử (co, h2, al, c).
fe3o4 + 4co → 3fe + 4co2 (điều kiện nhiệt độ)
fe2o3 + 3h2 → 2fe + 3h2o (điều kiện nhiệt độ)
fe2o3 + 2al → 2fe + al2o3 (điều kiện nhiệt độ)
Xem thêm:
- Hợp kim sắt: gang, thép là gì? Phân loại và phương pháp sản xuất
- Nhôm là kim loại nào? Tính chất, ứng dụng và phương pháp sản xuất của nhôm
Ứng dụng của kim loại đen
Kim loại sắt có mặt trong hầu hết mọi thứ, từ thiết bị gia dụng hàng ngày đến sản xuất. Sắt được sử dụng rộng rãi trong các ngành công nghiệp sau:
.jpg)
-
Thiết bị: Giá treo quần áo để đồ đạc, thùng rác, giá sắt, máy giặt, máy mài, dao, v.v.
Nội ngoại thất: Cầu thang, cửa sắt, cửa sắt, lan can, hàng rào sắt, tủ sắt, khung sắt, phụ kiện cửa, trụ đèn …
Giao thông: Cầu vượt, đường ray, cột đèn, khung cho một số phương tiện giao thông …
Ứng dụng trong ngành xây dựng: Giàn giáo sắt, chốt, trụ, lưới an toàn …
Công nghiệp máy móc: Các bộ phận máy móc, bộ phận máy móc, bản lề cửa. Không chỉ vậy, sắt còn là một trong những vật liệu quan trọng trong quá trình gia công các sản phẩm chủ lực sản xuất theo yêu cầu của khách hàng.
Nghiên cứu về kim loại đen, sách giáo khoa hóa học 9 và các giải pháp
Khi hiểu sâu hơn về lý thuyết kim loại đen, bạn có thể nắm vững những gì đã học bằng cách làm một số bài tập trong sách giáo khoa hóa học lớp 9.

Bài tập 1 (SGK Hóa học 9, trang 60)
Những tính chất hóa học của sắt là gì? Viết các phương trình hóa học minh họa.
Câu trả lời được đề xuất:
Sắt có các đặc tính sau:
- Hiệu ứng phi kim loại
- Phản ứng với oxy tạo thành oxit sắt:
3fe + 2o2 → (t0) fe3o4
- Phản ứng với clo tạo thành clorua sắt (iii)
2fe + 3cl2 → (t0) 2fecl3
- Phản ứng với các phi kim loại khác tạo thành muối.
- Phản ứng với dung dịch axit tạo thành muối sắt (ii) và giải phóng hydro
fe + 2hcl → fecl2 + h2 ↑
- Tương tác với nước muối
Sắt phản ứng với dung dịch muối của kim loại kém phản ứng để tạo thành muối mới và kim loại mới.
fe + cuso4 → feso4 + cu
Bài tập 2 (SGK Hóa học 9, trang 60)
Từ sắt và các hóa chất cần thiết, hãy viết các phương trình hóa học để thu được các oxit riêng biệt: fe3o4, fe2o3 và ghi rõ điều kiện phản ứng (nếu có).
Câu trả lời được đề xuất:
a) 3fe + 2o2 → (t0) fe3o4
b) 2fe + 3cl2 → (t0) 2fecl3
fecl3 + 3naoh → 3nacl + fe (oh) 3
2fe (oh) 3 → fe203 + 3h2o
Bài tập 3 (SGK Hóa học 9, trang 60)
Bột kim loại đen và tạp chất nhôm. Hãy giải thích cách làm sạch bàn là.
Câu trả lời được đề xuất:
Cho hỗn hợp bột kim loại vào dung dịch kiềm dư, nhôm sẽ bị kiềm tan ra
2al + 2naoh + 2h2o → 2naalo2 + 3h2
Bài tập 4 (SGK Hóa học 9, trang 60)
Sắt phản ứng với chất nào sau đây?
a) Dung dịch muối cu (số 3) 2
b) Sulfat rắn, nguội
c) khí cl2
d) giải pháp znso4.
Viết các phương trình hóa học và điều kiện, nếu có.
Câu trả lời được đề xuất:
Sắt phản ứng với dung dịch gồm cu (no3) 2 và khí cl2.
fe + cu (no3) 2 → fe (no3) 2 + cu
2fe + 3cl2 → (t0) 2fecl3
Bài tập 5 (SGK trang 60)
Ngâm bột sắt dư vào 10 ml dung dịch đồng sunfat 1M. Sau khi phản ứng xong, chất rắn a và dung dịch b được lọc bỏ.
a) Cho dung dịch HCl dư phản ứng. Tính khối lượng chất rắn còn lại sau phản ứng.
b) Tính thể tích dung dịch vừa đủ để dung dịch kết tủa b.
Câu trả lời được đề xuất:
a) ncuso4 = 1,0,01 = 0,01 mol
pthh: fe + cuso4 → feso4 + cu
Do thừa sắt nên chất rắn a gồm: Cu và fe dư
Cho a vào dung dịch hcl dư
fe + 2hcl → fecl2 + h2
=> Chất rắn còn lại là cu: mcu = 0,01,64 = 0,64 g
b) Giải pháp b chứa feso4
pthh: feso4 + 2naoh → na2so4 + fe (oh) 2
(mol) 0,01 0,02 0,01 0,01
Âm lượng mong muốn là
vddnaoh = n / cm = 0,02 / 1 = 0,02 lít = 20ml
Hy vọng bài viết này đã giúp bạn hiểu rõ hơn về kim loại đen và cách sử dụng sắt trong cuộc sống của bạn. Đừng quên ghé thăm website con khỉ mỗi ngày để đọc thêm nhiều kiến thức về bộ môn này nhé!
